1. Sự ra đời của màng PRF
Từ khoảng giữa đến cuối những năm 1990 là thời điểm bắt đầu ứng dụng tiểu cầu cô đặc nhằm thúc đẩy sự lành thương và tái tạo mô ở người với những phương thức khác nhau. Chế phẩm cô đặc tiểu cầu nhân tạo đầu tiên là PDGF được đưa vào thị trường dưới dạng tái tổ hợp (rhPDGF-BB). Chế phẩm này tương tự các yếu tố tăng trưởng (GFs) tự nhiên do tiểu cầu tiết ra tuy nhiên quy trình chế tạo lại phức tạp và giá thành cao. Cùng thời điểm đó, dựa trên ý tưởng có thể thu liều vượt mức sinh lý của tiểu cầu bằng cách quay ly tâm máu toàn phần ở người, Marx và cs (1998) lần đầu tiên giới thiệu thuật ngữ “huyết tương giàu tiểu cầu” (PRP).
PRP là một chế phẩm tiểu cầu cô đặc thế hệ đầu tiên được tạo ra nhằm mục đích thu được lượng tối đa tiểu cầu cùng các GFs sau khi quay ly tâm máu toàn phần để sử dụng lại chúng trong quá trình phẫu thuật. Với bản chất là các sản phẩm từ máu nên hiện tượng đông máu sẽ xảy ra trong vòng vài phút, rất khó thao tác và sử dụng trên lâm sàng, do đó, PRP phải sử dụng chất chống đông máu (CaCl2 hay thrombin bò). Khổ nỗi … chính những chất này lại ảnh hưởng tới mục đích sau cùng: ngăn cản tiến trình lành thương. Mặc dù vậy, y văn về PRP cho thấy PRP chứa hơn 95% tiểu cầu, các tế bào phóng thích các GFs liên quan đến quá trình lành thương của các loại tế bào khác nhau như tế bào tạo xương, tế bào biểu mô và tế bào mô liên kết (Max RE và cs 2004). Khởi đầu như vậy là tương đối ổn và đạt được các mục tiêu đề ra. Tiếp tục nghiên cứu, con người càng mong muốn sự hoàn thiện, hoàn thiện cả về ứng dụng thực tế trên lâm sàng (chế tạo đơn giản hơn, nhanh hơn) lẫn về phương diện sinh học (PRP phóng thích GFs nhanh và kết thúc sớm trong khi quá trình lành thương tiếp tục diễn tiến sau nhiều ngày (Kobayashi và cs 2016). 2000s Nhằm khắc phục những hạn chế của thế hệ tiểu cầu cô đặc đầu tiên, fibrin giàu tiểu cầu (PRF) được phát triển bởi bác sĩ Choukroun và cs (2000) là một sản phẩm tiểu cầu cô đặc thế hệ thứ hai chứa tiểu cầu và các GFs dưới dạng màng fibrin được chế tạo từ máu mà không cần thêm chất chống đông hay bất kỳ chất biến đổi sinh hóa nhân tạo nào khác. Cũng phải nhắc lại rằng cùng thời điểm hoặc trước đó 1 thời gian ngắn, tại Hoa Kì cũng có một tác giả đã bắt đầu chế tạo được thế hệ tiểu cầu cô đặc thứ hai là Arun K.Garg. Mặc dù cả thế giới nhắc đến Choukroun là inventor PRF nhưng chúng ta không thể phủ nhận công lao của Arun K.Garg. Quay trở lại câu chuyện chính, PRF được tạo ra bằng cách quay ly tâm máu tĩnh mạch ở tốc độ cao. Mục tiêu quay ly tâm ở tốc độ cao này là để tách riêng các lớp giữa tế bào hồng cầu ở đáy và lớp chất lỏng trong suốt chứa bạch cầu và huyết tương ở trên với một gel có cấu trúc mạng lưới fibrin ba chiều PRF.
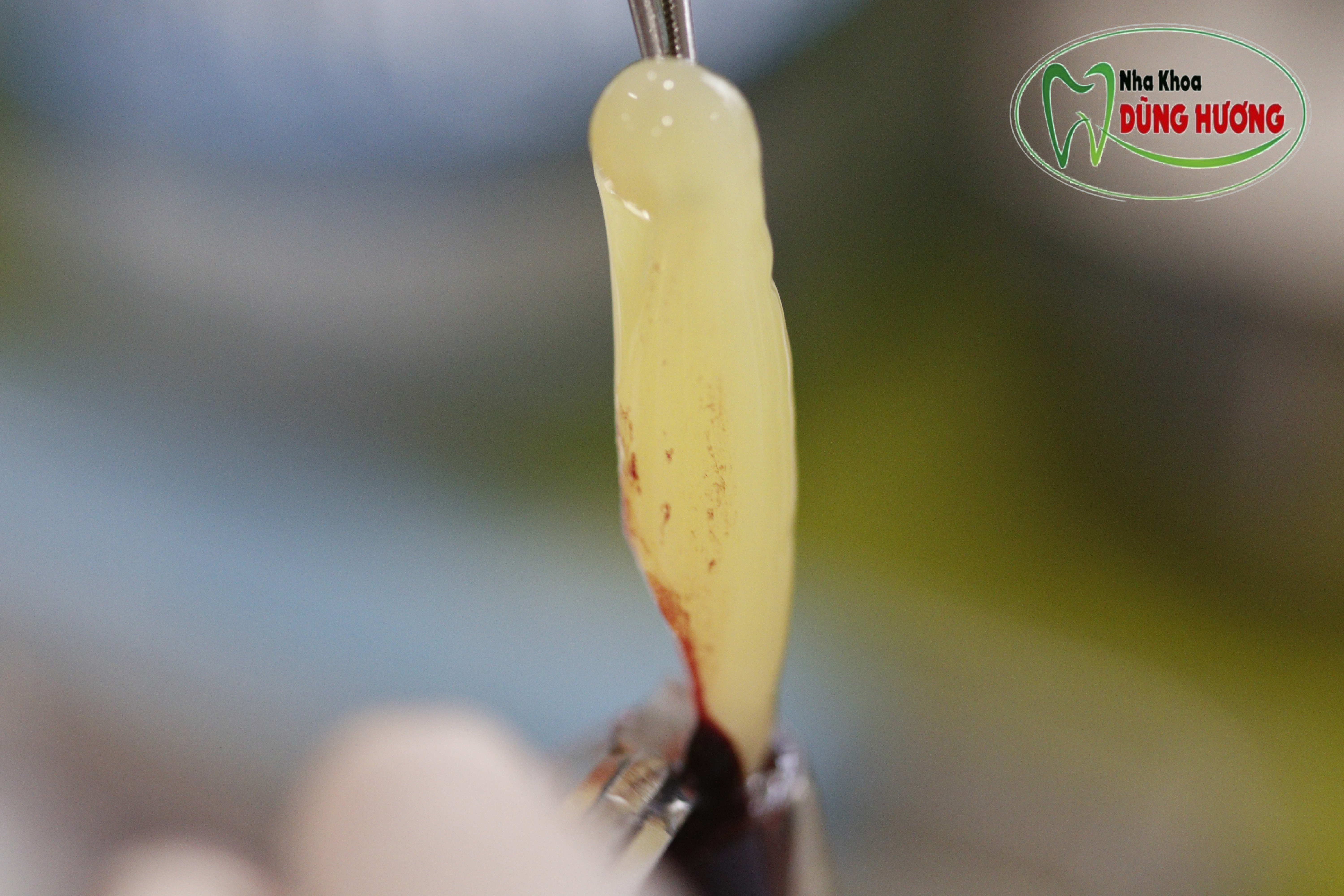
2. Ưu điểm của PRF so với thế hệ tiền nhiệm PRP
+ Rút ngắn thời gian chế tạo
+ Ít tốn kém và bảo tồn các đặc tính của một vật liệu tự thân do không cần thêm chất chống đông
+ Quan trọng hơn cả Ngoài ra PRF còn có lợi thế kéo dài thời gian phóng thích GFs do cấu trúc là khung lưới fibrin ba chiều chứa tế bào.
3. Thành phần của PRF
Các thành phần của PRF bao gồm ba thành phần chính: mạng lưới fibrin 3 chiều, các tế bào và các GFs tự nhiên.
+ Tiểu cầu là một trong những tế bào chính trong PRF: Tiểu cầu được giữ trong khung lưới fibrin 3 chiều cho phép chúng phóng thích các GFs chậm theo thời gian. Tiểu cầu khi được kích hoạt phóng thích các hạt α có chứa nhiều protein đặc hiệu (β-thromboglobulin) và không đặc hiệu (fibronectin, thrombospondin, fibrinogen …). Sau khi được kích hoạt, giải phóng các phân tử tín hiệu như PDGF (chịu trách nhiệm cho quá trình tái tạo), VEGF, TGF-β (Jenne và cs 2013). Bạch cầu, đại thực bào chế tiết các GFs trong quá trình lành thương như TGF-β, PDGF và VEGF. Các GFs này kích thích quá trình sinh mô sợi và mạch máu, nguyên bào sợi tạo khuôn ngoại bào hỗ trợ tăng trưởng tế bào. Chủ yếu lượng lớn bạch cầu được tìm thấy trong khung PRF được tìm thấy ở gần đáy của khối fibrin (Ehrenfest và cs 2009). Tế bào gốc trung mô (MSCs) cũng biểu hiện một vài GFs như FGF-2, VEGF thúc đẩy tăng sinh tế bào nội mô mạch máu, sự vững ổn mạch máu, sự phát triển của mạng lưới mạch máu lâu dài (Lozito và cs 2009).
Fibrin là thể hoạt hóa của fibrinogen là phân tử có trong huyết tương. Fibrin đóng vai trò quyết định giúp kết tập tiểu cầu trong quá trình đông cầm máu.
+ Khung PRF là một mạng lưới fibrin ba chiều, mang những đặc tính vượt trội về sinh học và cơ học của tiểu cầu cô đặc. Cấu trúc xốp bao gồm những dạng sợi fibrin mỏng nằm trong khối fibrin và có chức năng như là khung cho tế bào di cư, tăng sinh, biệt hóa và phóng thích GFs. Tiểu cầu được giữ lại phần lớn trong mạng lưới fibrin và sau đó phóng thích chậm và từ từ các GFs. Khối fibrin cũng tạo khung thu hút tế bào tới vùng tổn thương.Đặc biệt fibrin kết hợp với fibronectin đóng vai trò như một khung tạm cho bạch cầu đơn nhân, nguyên bào sợi, tế bào nội mô di cư, bám dính, tăng sinh và biệt hóa (Wu và cs 2013).
Yếu tố tăng trưởng (GFs) đại diện cho một nhóm lớn các phân tử polypeptide có vai trò điều hòa các phản ứng của tế bào sau khi gắn vào các thụ thể đặc hiệu trên màng tế bào. Các GFs thường tồn tại ở dạng không hoạt hóa hoặc hoạt hóa một phần.
Tóm lại chức năng của các GFs:
– Kích thích hoặc ức chế sự di cư, bám dính, tăng sinh và biệt hóa tế bào
– Thúc đẩy sự tăng sinh mạch máu và tái tạo mô trong quá trình lành thương
– Yếu tố liên quan đến quá trình hình thành và phát triển xương.
4. Quy trình quay li tâm như thế nào để thu được PRF?
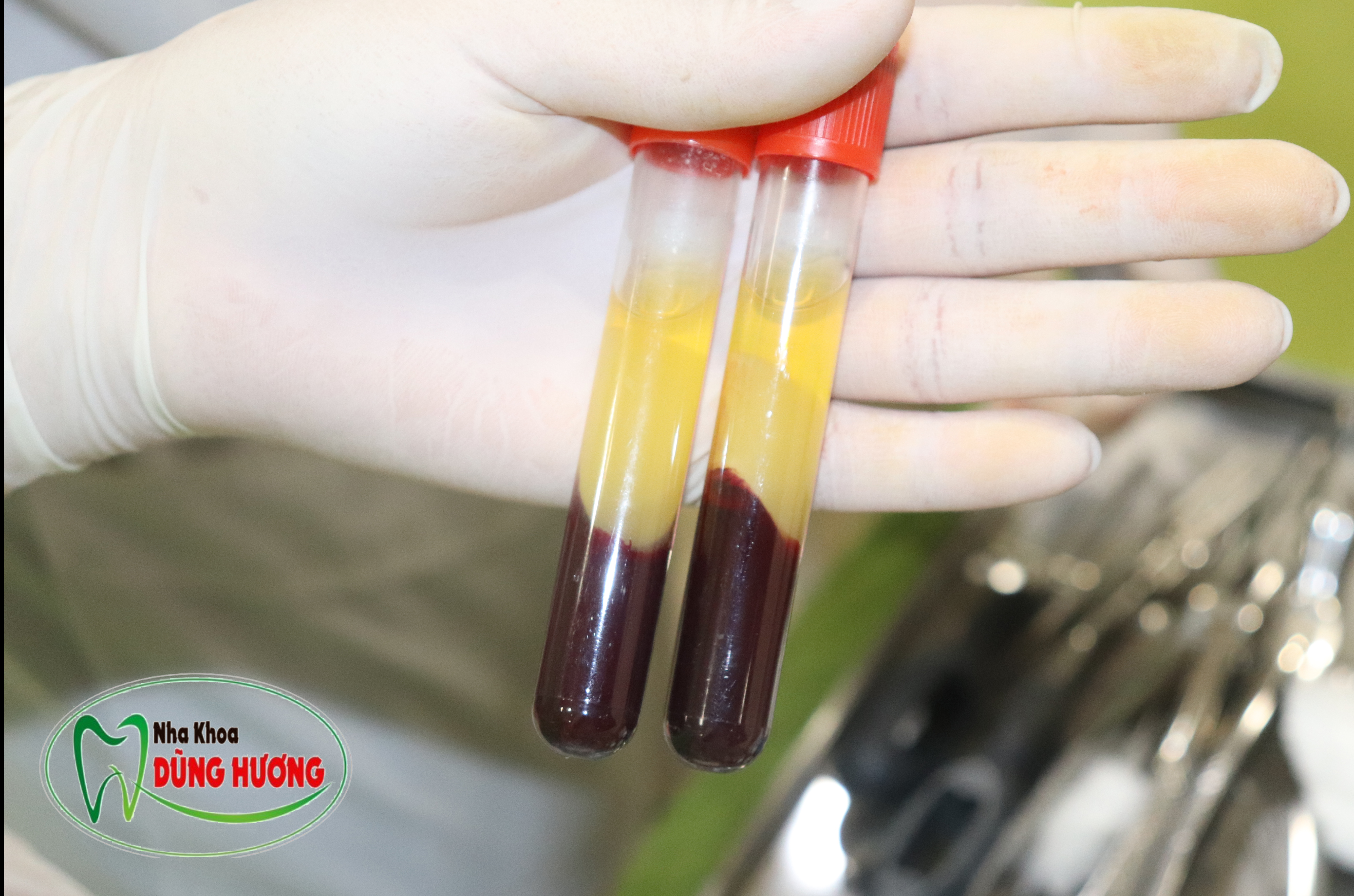
Lực khi quay li tâm sẽ quyết định nhiều yếu tố từ dạng sử dụng (phương diện lâm sàng) cho đến yếu tố lưu giữ tế bào trong mạng fibrin 3 chiều (phương diện sinh học). Chính vì thế 2 yếu tố cần quan tâm là thời gian quay và số vòng/ phút. L-PRF là quy trình đầu tiên: tốc độ 2700 vòng/phút trong 12 phút. Các công trình tiếp theo nghiên cứu của nhóm tác giả Miron, Kobayashi, Choukroun cho mất nhiều tiểu cầu và bạch cầu ra khỏi lưới fibrin. Nguyên nhân do lực quay ly tâm lớn tạo lực kéo tế bào di chuyển về đáy ống nghiệm. Để cải thiện điểm hạn chế trên, concept mới quay li tâm tốc độ chậm. Theo đó, tốc độ quay được điều chỉnh giảm xuống còn 1300 vòng/phút trong 14 phút (A-PRF) và giảm luôn cả thời gian còn 8 phút (A-PRF+) đã được chứng minh có cấu trúc lưới fibrin xốp hơn, giúp giữ lại số lượng bạch cầu và tiểu cầu nhiều hơn và lượng GFs phóng thích cao hơn PRF trong vòng 10 ngày. Ngoài ra lực quay ly tâm giảm giúp các tế bào phân bố đều hơn trên khung fibrin so với PRF thế hệ trước (Ghanaati và cs 2014). Trên lâm sàng với yêu cầu tạo sticky bone dùng trong ghép xương thì mới năm 2019 vừa rồi, Choukroun có ghé sang VN làm hội thảo giới thiệu ống máu 10ml màu xanh chuyên để chế tạo Sticky bone (S-PRF) với cùng quy trình như A-PRF (ống máu màu đỏ). S-PRF và iPRF (ống máu màu vàng cam) đều là 2 dạng liquid, không đông thành dạng màng như các loại PRF khác, đặc biệt iPRF dùng để tiêm, bơm tuỳ theo trường hợp lâm sàng cụ thể. Tất cả các dạng PRF vừa nêu đều được quay bởi máy có góc độ cố định sẵn, trên lâm sàng quý đồng nghiệp thấy ống nghiệm được để một góc hơi nghiêng so với mặt phẳng ngang (fix-angle), mới đây nhất Kobayashi và Miron 2020 publish các công trình về H-PRF (H: Horizontal): dùng máy đặt ống nghiệm theo phương vuông góc với mặt phẳng ngang; H-PRF bước đầu cho kết quả mạnh như con iphone Promax vậy: tăng 20% tiểu cầu và lên tới 400% bạch cầu
Nguồn: BS Đoàn Lâm Tú – Team SYD




